- Лёд и другие состояния воды
- Ответы на ваши вопросы
- Какой лёд лучше?
- 11 агрегатное состояние воды
- Вода при 4 градусах Цельсия
- Лёд из воды с сахаром (или другим веществом)
- Вред средств против обледенения, применяемых на дорогах
- Изготовление льда в виде кубов
- Повышение устойчивости льда при плюсовой температуре
- Лёд – твердое состояние воды, его свойства, классификация, формы и фото …
- Лёд — что это …
- Большой Энциклопедический словарь
- Морской словарь
- Словарь по географии
- Свойства льда — свойства воды в твердом состоянии
- Виды льда — классификация льдов
- Формы льда в природе
- Основные агрегатные состояния вещества
- Агрегатные состояния вещества
- Твердое состояние
- Жидкое состояние
- Газообразное состояние
- Фазовые переходы: изменение агрегатных состояний вещества
- График фазовых переходов
- Решение задач по фазовым переходам
- Сублимация и десублимация
- Влажность воздуха: испарение и конденсация
- Как влажность влияет на человека
Лёд и другие состояния воды
Ответы на ваши вопросы
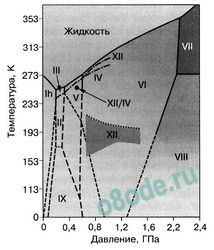
В природе существует 14 модификаций льда. Правда, все, кроме привычного нам льда, кристаллизующего в гексагональной сингонии и обозначающегося как лёд I , образуются в условиях экзотических — при очень низких температурах (порядка -110- 150 0С ) и высоких давлениях, когда углы водородных связей в молекуле воды изменяются и образуются системы, отличные от гексагональной.
Природный лёд I обычно значительно чище, чем вода, т.к. растворимость веществ (кроме NH4F) во льде крайне низкая. А вот лёд II наоборот стабилизуется только в присутствии следовых количеств газов; в чистом виде его никто не получал из-за его нестабильности. Если, например, давление создают с помощью гелия, он обязательно растворится в замерзающей воде.
Какой лёд лучше?
При замораживании воды в пластиковых бутылках заметно, что сначала появляется прозрачный лёд, как слеза, а в центре бутылки, в последнюю очередь замерзания, образуется мутный, непрозрачный лёд. Какие свойства этих двух видов льда и какой предпочтительнее употреблять после размораживания?
Замораживать воду лучше всего в посуде, изготовленной из прочного стекла. Для этого подойдёт любая ёмкость – банка, кастрюля и т.д. и т.п. А ответ на ваш вопрос почему лёд кристаллизуется таким образом заключается в том, что превращение жидкости в кристалл происходит в первую очередь на центрах кристаллизации; примесях и неоднородностях — частичках пыли, пузырьках воздуха, мельчайших царапинах на стенках сосуда. Чистая вода центров кристаллизации практически лишена, поэтому она может переохлаждаться, и довольно сильно, оставаясь жидкой, но мельчайшие пузырьки воздуха вода всегда содержит. Они то и являются причиной наблюдаемого эффекта.
11 агрегатное состояние воды
меня очень интересует то как получили 11 агрегатное состояние воды.
Все вещества в природе согласно законам термодинамики могут существовать в трех агрегатных состояниях — твердом, жидком и газообразном. Вода в свою очередь может существовать в виде жидкости, пара и льда. Лёд в свою очередь имеет 14 модификаций, большинство которых, однако, получены в условиях, близких к космическим. Переходы между ними сопровождаются скачкообразным изменением ряда физических свойств (плотности, теплопроводности и др.).
Четвертым агрегатным состоянием вещества часто считают плазму, хотя к воде плазма не имеет никакого отношения. Термин плазма (от греч. πλάσμα «вылепленное», «оформленное») был введен в 1929 году американскими учеными И. Ленгмюром и Л. Тонксом, возможно из-за ассоциации с плазмой крови, что по-сути не верно.. В физическом смысле плазма и есть четвёртое агрегатное состояние вещества.
Вода при 4 градусах Цельсия
При 4 °С вода имеет максимальную плотность. Почему? почему вода на дне водоема именно при этой температуре? заранее спс. Саша
Вода — одно из самых загадочных веществ нашей планеты. Будучи нормальным мономолекулярным соединением, она должна была бы кипеть при + 70°C, а замерзать почти при -100°C. В отличие от всех остальных жидкостей, вода при затвердевании уменьшает свой вес. Максимальная плотность воды наблюдается при +4°C. Этот факт чрезвычайно важен для биосферы. В результате лед образуется на поверхности водоемов, не давая им промерзать до дна, и, тем самым, не давая погибнуть рыбам и прочим представителям водной фауны в зимнее время.
Лёд из воды с сахаром (или другим веществом)
Добрый день. Можете мне объяснить по структуре кристалла льда. Например при замерзании чистой воды, в узлах кристалл решетки находятся молекулы воды. А вот например, если замерзает сладкая вода (вода в которой разбавлен сахар), то в узлах кристалл решетки кристалла находятся молекулы воды и молекулы сахара (вместо сахара, можно использовать любое другое вещество растворяющееся в воде)? Павел Сергеевич, Черновцы
Здравствуйте, уважаемый Павел Сергеевич. Теоретически, большинство молекул белков, жиров и углеводов по своему строению довольно идеально подходят к структуре льда, как бы “вписываясь” в пустоты его кристаллической решетки. Но на практике всё происходит совершенно иначе. Замерзая и превращаясь в лёд вода как бы изгоняет из растущего кристалла все примеси и чужеродные молекулы. Именно на этом принципе и основано очищение воды методом замораживания-оттаивания, когда в результате получается свободная от примесей талая вода.
Вред средств против обледенения, применяемых на дорогах
Не могли бы Вы ответить на следующий вопрос: приводят ли к заражению почвы нитратами антиобледениетельные средства, применяемые на дрогах в зимний период? Константин.
Конечное, привести к загрязнению почвы нитратами антигололёдные реагенты, применяемые сегодня на улицах Москвы для борьбы со льдом, не могут, хотя такая теоретическая возможность не исключается в случае антигололёдных реагентов на основе ацетата аммония.
Однако, как только речь заходит об антигололедных реагентах, пешеходы начинают жаловаться на испорченную верхнюю одежду и обувь, а водители вспоминают грязную жижу, летящую из-под колес, и изъеденные коррозией кузова. По словам специалистов столичных служб, занимающихся очисткой дорог, реагенты уже давно стали практически экологически чистыми, а грязь на дорогах появляется из-за самих автомобилистов, которые привозят ее на колесах своих машин из Подмосковья. Однако эксперты утверждают, что реагенты не так уж и безобидны для экологии и здоровья человека, а применение их может принести существенный вред экологии.
Изготовление льда в виде кубов
Здравствуйте Олег! Могли бы Вы мне помочь? Вопрос вот в чем: я хотела бы изготавливать лед в виде кубов, но сколько бы я не пробовала их делать, кубы получаются с белым пятном внутри, хотя я использовала очищенную воду и даже дистиллированную. Также почему то внутри куба появляется большое количество пузырьков. Я очень надеюсь,что Вы сможете мне помочь. Заранее большое спасибо! Виктория.
Здравствуйте, Виктория! Столь странное поведение ваших кубиков льда объясняется особенностями процесса кристаллизации. Превращение жидкости в кристалл происходит в первую очередь на центрах кристаллизации; примесях и неоднородностях — частичках пыли, пузырьках воздуха, мельчайших царапинах на стенках сосуда. Чистая вода центров кристаллизации практически лишена, поэтому она может переохлаждаться, и довольно сильно, оставаясь жидкой, но мельчайшие пузырьки воздуха вода всегда содержит. Они то и являются причиной наблюдаемого эффекта. В лабораторных условиях температуру воды, правда, в очень малых объёмах, удавалось довести до –70°С.
Повышение устойчивости льда при плюсовой температуре
Здравствуйте. Меня зовут Сергей. Я являюсь владельцем ледового комплекса в г.Винница (Украина). Меня интересует или возможно повысить устойчивость льда при плюсовой температуре без дополнительных затрат электроэнергии. Очень дорого содержать лёд летом. Я читал статьи по поводу метана в воде, молекул белка и по поводу тяжёлой воды D2O. Не знаю как это применить на практике.
В природе существует 14 модификаций льда. Правда, все, кроме привычного нам льда, кристаллизующего в гексагональной сингонии и обозначающегося как лёд I , образуются в условиях экзотических — при очень низких температурах (порядка -110150 0С ) и высоких давлениях, когда углы водородных связей в молекуле воды изменяются и образуются системы, отличные от гексагональной. Такие условия напоминают космические и не встречаются на Земле. Например, при температуре ниже –110 °С водяные пары выпадают на металлической пластине в виде октаэдров и кубиков размером в несколько нанометров — это так называемый кубический лед. Если температура чуть выше –110 °С, а концентрация пара очень мала, на пластине формируется слой исключительно плотного аморфного льда.
Источник
Лёд – твердое состояние воды, его свойства, классификация, формы и фото …
Лёд – хорошо знакомое для большинства из нас вещество. Он всегда вокруг нас в зимнюю пору. В быту мы часто пользуемся его уникальными свойствами …
Лёд — что это …
Лёд — это твёрдое состояние воды. Он образуется при понижении температуры воды ниже 0 градусов по Цельсию. Эта температура называется температурой Кристаллизации воды. Лёд, как и снег, состоит из кристаллов льда, с формами которых вы можете ознакомиться в нашей статье Снег кружится.
Приведем ещё несколько определений.
Большой Энциклопедический словарь
Лед — вода в твердом состоянии. Известны 11 кристаллических модификаций льда и аморфный лед. В природе обнаружена только одна форма льда — с плотностью 0,92 г/см³, теплоемкостью 2,09 кДж/(кг.К) при 0 °C , теплотой плавления 324 кДж/кг, которая встречается в виде собственно льда (материкового, плавающего, подземного), снега и инея. На Земле ок. 30 млн. км³ льда. Используется для хранения, охлаждения пищевых. продуктов, получения пресной воды, в медицине.
Большой Энциклопедический словарь. 2000
Морской словарь
Лед (Ice) — вода в твердом состоянии. Обыкновенный лед легче воды, удельный вес при 0° — 0,9175. Сто объемов Льда образуются из 92 объемов воды, этим объясняется разрушительное действие воды при замерзании в закрытых сосудах, трубопроводах, отсеках и т. п.
Самойлов К. И. Морской словарь. — М.-Л.: Государственное Военно-морское Издательство НКВМФ Союза ССР, 1941
Словарь по географии
Лед — Твердая форма воды, образуемая в природе путем замерзания воды на реках, озерах и морях, конденсации атмосферного водяного пара в ледяные кристаллы, уплотнения снега и т.п.
Словарь по географии. 2015
Свойства льда — свойства воды в твердом состоянии
В результате процесса образования льда – кристаллизации воды, выделяется некоторое количество газов и солей. Это свойство используется для очистки питьевой воды, подробно про это мы писали в материале ТАЛАЯ ВОДА, ПРИГОТОВЛЕНИЕ В ДОМАШНИХ УСЛОВИЯХ → .
Лёд имеет меньшую плотность чем жидкая вода, поэтому он и не тонет. Это свойство относится к аномальным. Поскольку, как правило, большинство веществ, в твердом состоянии имеет большую плотность. Меньшая плотность льда говорит о том, что вода при замерзании увеличивается в объеме. Этот факт необходимо учитывать в быту. Например, если замерзнет водопровод, то образовавшийся в процессе этого лёд может «порвать» трубы.
Свойства воды в твёрдом состоянии как таковые мы уже рассматривали и в других наших материалах — ЛЕДНИК — ХРАНИТЕЛЬ ПРЕСНОЙ ВОДЫ → , БЕЛЫЕ СНЕЖИНКИ НА НОВЫЙ ГОД → , СНЕГ КРУЖИТСЯ → . Тем не менее ещё раз перечислим главные из них ниже.
- Лёд начинает образовываться … или иначе говоря вода переходит в твердое состояние при температуре равной 0 °C (при условии, что атмосферное давление равняется 760 мм рт.ст. / 1 атм).
- Замерзая, вода увеличивается в объеме. Плотность льда меньше плотности жидкой воды, удельный вес льда при 0° = 0,917 и соответственно удельный вес воды при 0° = 0,9999. Именно поэтому лед и не тонет. Это свойство воды является аномальным.
- При дальнейшем понижении температуры, лёд сжимается, чем и объясняются трещины на больших лёдовых пространствах.
- Теплоемкость льда ниже, чем у воды практически в 2 раза.
- Температура замерзания морской воды выше чем у пресной и равняется
1,80 °C (при условии солености воды на уровне средне-взвешенного уровня по мировому океану) .
Виды льда — классификация льдов
- Почвенный лёд – лёд, образовавшийся в границах земной коры;
- Речной лёд;
- Льды, образовавшиеся при замерзании озер;
- Морские льды.
Формы льда в природе
В природе встречается несколько проявлений воды в твёрдом состоянии.
- Лёд:
- плавающие — льды, покрывающие водные бассейны при замерзании, айсберги … ;
- материковые – ледники …;
- подземные льды.
- Снежинки.
- Иней.
- Сосульки.
- Изморозь.
- …
Источник
Основные агрегатные состояния вещества
О чем эта статья:
Агрегатные состояния вещества
Чтобы разобраться с тем, какими бывают агрегатные состояния, предлагаю по ходу чтения статьи заполнять таблицу.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
Лед, вода и водяной пар — это все три агрегатных состояния одного вещества. Лед — твердое состояние, вода — жидкая, пар — газообразное. Для каждого вещества существует три состояния.
Твердое состояние
Его очень легко представить — это любой предмет, который мы встречаем в жизни. В этом состоянии тело сохраняет форму и объем. Расстояние между молекулами, приблизительно равно размеру самих молекул, которые, в свою очередь, расположены очень структурированно.
Такая структура называется кристаллической решеткой — из-за четкой структуры молекулам сложно двигаться, и они просто колеблются около своих положений.
Заполняем нашу табличку
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
Жидкое состояние
В этом состоянии сохраняется объем, но не сохраняется форма. Например, если перелить молоко из кувшина в стакан, то молоко, имевшее форму кувшина, примет форму стакана. Кстати, в корове у молока тоже была другая форма.

Расстояние между молекулами в жидком состоянии чуть больше, чем в твердом, но все равно невелико. При этом частицы не собраны в кристаллическую решетку, а расположены хаотично. Молекулы почти не двигаются, но при нагревании жидкости делают это более охотно.
Вспомните, что происходит, если залить чайный пакетик холодной водой — он почти не заваривается. А вот если налить кипяточку — чай точно будет готов.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
Газообразное состояние
В жизни мы встречаем газообразное состояние вещества, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (он занимает весь предоставленный ему объем), состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
занимают предоставленный объем
больше размеров молекул
хаотичное и непрерывное
С агрегатными состояниями разобрались, ура! Но до сих пор неясно, каким образом у каждого вещества их целых три, и как одно переходит в другое. Для этого узнаем, что такое фазовые переходы.
Фазовые переходы: изменение агрегатных состояний вещества
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Фазовые переходы интересны тем, что все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы металлургии и микроэлектроники.
На схеме — названия всех фазовых переходов:

Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
График фазовых переходов
Если взять процесс превращения льда в воду, воды — в пар, и обратные действия, то мы получим очень информативный график.
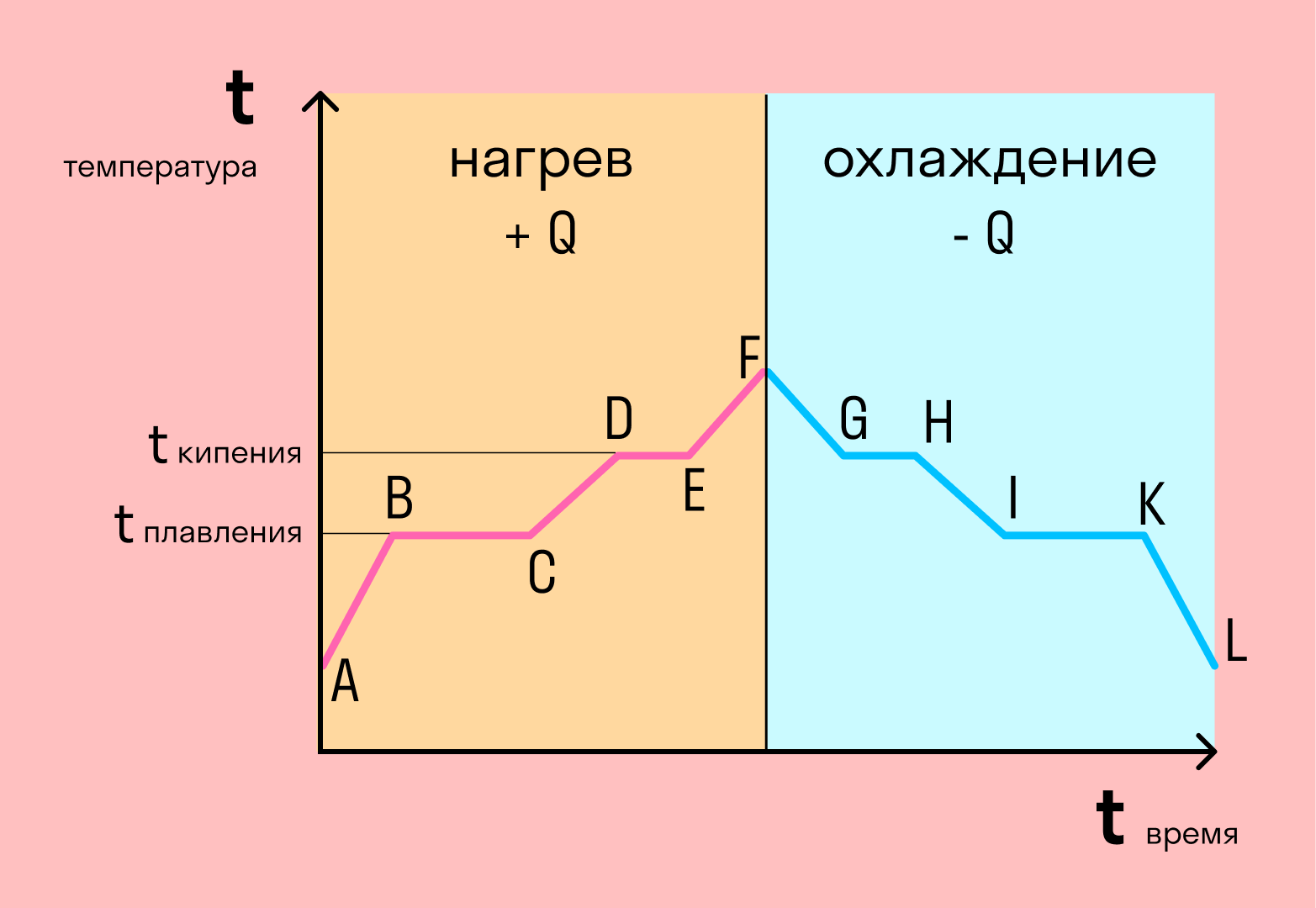
Разбираемся по шагам. Сначала взяли лед, конечно, при отрицательной температуре, потому что при нуле лед начинает плавиться. Нагрели лед до температуры плавления (до 0 градусов).
- AB — нагревание льда
После того, как лед нагрелся до температуры плавления, он начинает плавиться. Плавление происходит при постоянной температуре тем дольше длится, чем больше масса плавящегося вещества. Еще этот процесс зависит от свойств самого вещества, но об этом немного позже.
- BC — плавление льда
Расправившись вещество уже в жидком состоянии снова начинает нагреваться, и температура увеличивается, пока не достигает температуры кипения. В данном случае нагревается вода — это значит, что ее температура кипения равна 100 градусам Цельсия.
- CD — нагревание воды
При 100 градусах вода кипит, пока не выкипит целиком. В данном случае процесс аналогично плавлению происходит при постоянной температуре. Данный процесс нельзя путать с испарением, потому что парообразование происходит при конкретной температуре, а испарение — при любой.
- DE — кипение (парообразование) воды
Далее полученный пар нагревается, но путем нагревания невозможно дойти до другого фазового перехода — можно пойти только обратно.
- EF — нагревание пара
Первый шаг в обратную сторону — охлаждение до температуры кипения.
- FG — охлаждение пара
Дойдя до температуры кипения (в данном случае 100 градусов), пар начинает переходить в жидкое состояние. Этот процесс также происходит при постоянной температуре.
- GH — конденсация пара
Сконденсировавшись, вода охлаждается, пока не начнет замерзать.
- HI — охлаждение воды
Кристаллизуется (замерзает) вода при той же температуре, что и плавится лед — 0 градусов. Кристаллизация также происходит при постоянной температуре.
- IK — кристаллизация воды
После кристаллизации лед охлаждается.
- KL — охлаждение льда
С нагреванием и охлаждением все совсем просто — мы либо передаем теплоту телу (веществу), и оно идет на увеличение температуры, либо тело отдает тепло и охлаждается.
В остальных процессах температура не меняется. Это связано с тем, что количество теплоты не всегда зависит от температуры. Формулы для всех процессов выглядят так:
Нагревание
Охлаждение
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
m — масса [кг]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
Плавление
Кристаллизация
Q — количество теплоты [Дж]
λ — удельная теплота плавления вещества [Дж/кг]
m — масса [кг]
Парообразование
Конденсация
Q — количество теплоты [Дж]
L — удельная теплота парообразования вещества [Дж/кг]
m — масса [кг]
Решение задач по фазовым переходам
С теорией разобрались — а теперь давайте практиковаться!
Задачка раз. Температура медного образца массой 100 г повысилась с 20 °С до 60 °С. Какое количество теплоты получил образец? Удельную теплоёмкость меди считать равной 380 Дж/(кг умножить на °С)
Сначала нужно перевести массу в килограммы:
Берем формулу количества теплоты для нагревания вещества:
Q = 380 * 0,1*(60-20) = 1520 Дж
Ответ: образец получил 1520 Дж
Задачка два. Какое количество теплоты необходимо для плавления 2,5 т стали, взятой при температуре плавления? Удельная теплота плавления стали λ=80кДж/кг. Теплопотерями пренебречь.
Сначала нужно перевести массу в килограммы и удельную теплоту в Дж/кг:
80 кДж/кг = 80000 Дж/кг
Берем формулу количества теплоты для плавления вещества:
Q = 80000*2500 = 200 000 000 Дж = 200 МДж
Ответ: для плавления 2,5 т стали необходимо 200 МДж теплоты.
Сублимация и десублимация
Мы уже рассказали про такие процессы, как сублимация и десублимация.
- Переход из твердого состояния в газообразное, минуя жидкое — сублимация (возгонка);
- Переход из газообразного состояния в твердое, минуя жидкое — десублимация.